악성 대동맥소체종양(Aortic Body Tumor) 치료 증례: 수술적 제거, 심낭절제술 및 PDST를 이용한 항암치료
- 작성자
- 관리자
- 등록일
- 2024-06-25
- 조회수
- 3,481
악성 대동맥소체종양(Aortic Body Tumor)치료 증례 :수술적 제거, 심낭절제술 및 PDST를 이용한 항암치료
VIP동물의료센터
박종원 수의사
임윤지 원장
[Introduction]
심장 종양은 심장 내 조직 또는 주변 조직으로 부터 기인한다. 개에서 흔한 심장 종양 유형에는 혈관육종(HSA), 대동맥소체종양(ABT)이 있다.(1) 이 글에서 다루게 될 대동맥소체종양은 여러 개의 동의어가 있으며, 동의어로는 heart base tumor, chemodectoma, cardiac paraganglioma, APUDoma, glomus body tumor가 있다.(2)
대동맥소체종양은 개의 심장 종양 중 8%를 차지하며(3), 혈관육종 다음 2번째로 가장 흔한 유형이지만 현재 치료에 대한 정보는 부족하다.(4) 대동맥소체종양 중 가장 흔한 유형은 화학수용체종(chemodectoma)이며, 화학수용체종은 대동맥소체의 화학수용체 세포로부터 기인한다.(5) 대동맥소체의 화학수용체는 특화된 신경상피세포의 군집이며, 이 신경상피세포는 혈액의 산소, 이산화탄소, pH, 온도의 극미한 변화를 감지하는 역할을 한다.(6)
화학수용체종은 보통 심장 기저부에 하나의 종양으로 나타나며, 흔히 대동맥과 폐동맥 사이, 대동맥과 우심방 사이, 폐동맥과 좌심방 사이에 위치한다.(7) 화학수용체종은 비기능적이며, 일반적으로 최대 22%의 낮은 전이율을 갖는 국소 침습 종양이다.(3) 전이가 되는 가장 흔한 장소는 부위 림프절, 심근, 폐, 간, 부신, 뇌다.(5) 화학수용체종은 종종 영상검사 또는 부검시에 우연히 발견된다.(3) 대동맥소체종양의 임상 증상은 종양 진행 단계 및 크기에 따라 다양하며, 종양의 크기가 작을 때는 대부분 임상 증상을 유발하지 않고 있다가 종양이 어느 정도 커져 대혈관에 영향을 끼치거나 상당한 심낭수를 생성시킬 정도가 되어야 임상 증상이 나타난다. 가장 흔히 보고되는 임상 증상은 운동 불내성, 실신, 호흡곤란, 기침 등이지만 무증상인 경우도 있다. 임상 증상과 함께 흔히 관찰되는 소견으로는 심낭수, 울혈성 우심부전과 연관된 경정맥 노장, 흉수, 복수, 말초 부종이 있다.(8, 9) 급성의 치명적인 출혈이 드물게 보고되기도 한다.(10)
본 증례에서는 악성 대동맥소체종양 치료 증례를 통해 악성 대동맥소체종양의 진단, 치료, 예후에 대해서 고찰하고자 한다.
[Case]
본 증례 환자는 미니어쳐 슈나우져, 13살, 중성화한 수컷이다. 2022년 3월 심장 전문 동물병원에서 건강검진 중 심장 종양이 발견되어 본원으로 내원하게 되었다. 내원 당시 심장 종양과 관련된 임상 증상은 나타나지 않았으며, 식욕이나 기력 모두 양호하였으며, 체중 변화도 없었다. 심장초음파 상에서 종양은 심장 기저부에 위치해 있었으며, 위치가 심장 기저부이기 때문에 화학수용체종, 림프종, 혈관육종 등의 종양이 의심되었다. 그리고 좀 더 정확한 진단을 위해 CT 촬영과 동시에 FNA 검사를 진행하려 했다. 하지만 CT 촬영 당시 종괴 위치를 봤을 때 위험성이 높아 FNA는 진행하지 못했다. CT 이미지 상 종괴는 심장 기저부 수준 오름대동맥 좌외측영역에서 4cm 크기로 확인되었으며, 강하고 불균질하게 조영증강되는 것으로 나타났다.(그림1.A) 종괴는 대동맥, 폐동맥, 좌심과 인접했으며, 전대정맥에서 종괴로 분지하는 혈관이 확인되었다.(그림1.B) 세포 검사는 진행하지 못했지만, CT 이미지 상 나타난 종괴 위치를 근거로 화학수용체종으로 추정 진단 내리게 되었다.
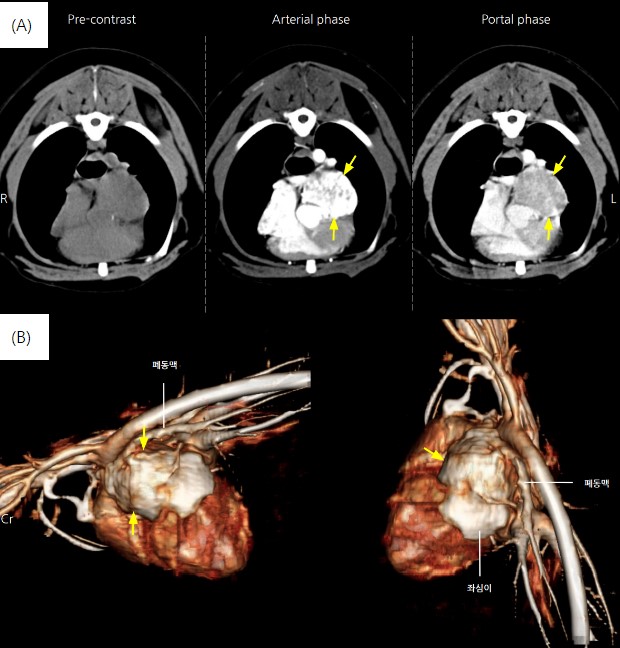
그림 1. (A) CT 조영 이미지 (B) CT 3D 이미지
CT 촬영 이후 보호자께 제시한 치료 옵션은 4가지였다. 첫번째는 수술적 제거 및 심낭절제술이다. 종양을 완전히 절제하는 것이 가장 좋은 방법이지만 완전한 절제를 위해서는 대동맥 치환술이 필요하다. 수의에서는 아직까지 인공심폐기 사용이 쉽지 않을뿐더러 동물에서 사용가능한 인조 대동맥이 없어 대동맥 치환술을 통한 완전한 절제는 불가능하다. 따라서 종양을 최대한 제거하는 부분적 절제를 보호자께 제시하였다. 대형 혈관에서 발생한 종양이기 때문에 수술 위험성이 높음을 고지하였으며, 수술적 제거가 불가능할 시 심낭수 축적을 예방하기 위해 심낭절제술만이라도 진행하기로 했다. 두번째는 방사선 치료다. 효과가 있는 경우 종괴 크기가 감소하지만, 효과가 없는 경우 방사선 치료 기간 동안에도 종괴 크기가 커져 수술이 불가능할 가능성이 존재한다. 세번째는 항암치료다. 크기 감소 효과는 뚜렷하지 못하지만 증식 속도 지연 목적으로는 선택가능한 옵션이다. 네번째는 호스피스 케어다. 보호자는 첫번째 옵션인 수술적 제거 및 심낭절제술을 선택했다. 이후 진행된 수술에서 수술적 제거 및 심낭절제술 모두 가능했다.(그림2)
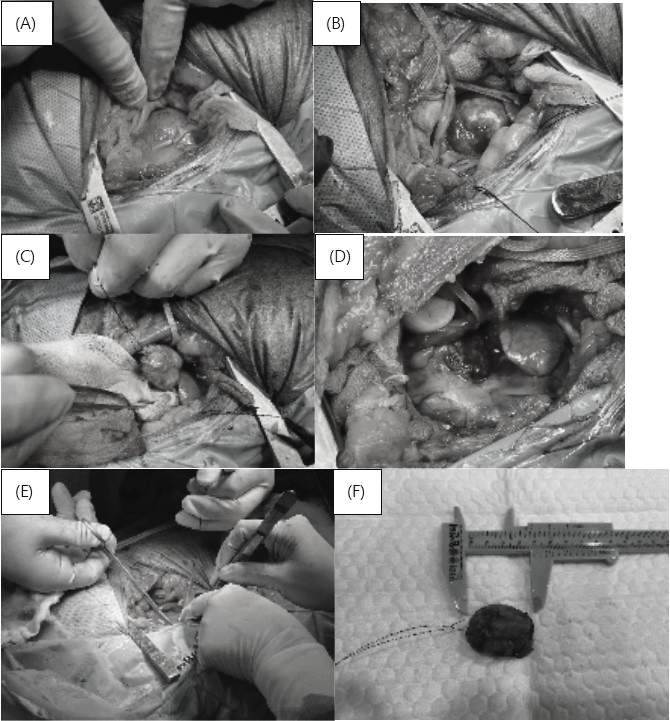
그림 2. (A) 개흉 후 심낭 내 종양 (B) 심낭 절개 후 드러난 종양 (C) 봉합사에 걸린 종양 (D) 종양 절제 후 (E) 심낭절제술 (F) 절제된 종양
절제한 종양 조직은 조직 검사 및 면역조직화학 검사, 항암제 감수성 검사(PDST) 의뢰하였다. 조직 검사 및 면역조직화학 검사 결과 neuroendocrine carcinoma/chemodectoma로 진단되었으며, 항암제 감수성 검사(PDST) 결과 carboplatin+imatinib 조합이 가장 항암 효과를 나타내는 것으로 확인되었다.(그림3)
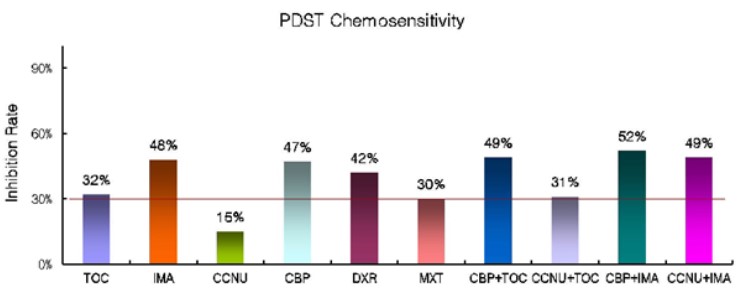
그림 3. PDST 검사 결과
이러한 조직 검사 및 항암제 감수성 검사 결과를 토대로 3주 간격으로 총 여섯 차례에 걸쳐 carboplatin  IV 투여가 진행되었으며, 이후에는 1일1회 imatinib(8mg/kg) 경구 투여가 현재까지 진행되고 있다. 본 환자는 첫 내원부터 현재까지 약 750일간 생존하고 있으며, 항암제 부작용인 골수 억압, 신독성, 소화기 증상은 나타나지 않고 있다. 그리고 종양으로 인한 임상 증상인 운동 불내성, 실신, 호흡곤란, 기침 등도 나타나지 않고 있다.
IV 투여가 진행되었으며, 이후에는 1일1회 imatinib(8mg/kg) 경구 투여가 현재까지 진행되고 있다. 본 환자는 첫 내원부터 현재까지 약 750일간 생존하고 있으며, 항암제 부작용인 골수 억압, 신독성, 소화기 증상은 나타나지 않고 있다. 그리고 종양으로 인한 임상 증상인 운동 불내성, 실신, 호흡곤란, 기침 등도 나타나지 않고 있다.
소실된 것으로 보였던 종양이 항암치료 시작 8개월 후 심장 초음파 검사 상 2x1cm 크기로 관찰되었다. 종양 크기가 더 커지지는 않는지 모니터링 하기로 하였으며, 더 커질 경우 항암제 교체를 고려하려 했다. 이후 1년 동안 주기적으로 진행된 심장 초음파 검사 상 종양 크기는 2x1cm 내지 1.5x1cm로 측정되어 측정 오차범위 내에서 더 이상 커지지는 않는 것으로 판단하였다.
[Discussion]
대동맥소체종양 진단은 크게 추정 진단과 확정 진단으로 나눌 수 있다. 추정 진단은 문진, 신체검사, 흉부 방사선, 심장 초음파, CT/MRI에 의해 이뤄지며, 확정 진단은 세포 검사 또는 조직 검사를 통해 이뤄진다.(11) 문진에서는 관련 임상 증상을 확인할 수 있다. 신체 검사에서는 심낭압전에 의한 변화를 관찰할 수 있다. 흉부 방사선에서는 심낭수로 인한 크고 둥근 형태의 심장 음영, 폐문 주위에 종괴, 심장 기저부 쪽 기관의 등쪽 변위, 폐 전이, 흉수가 관찰된다. 심장초음파는 흔히 심장기저부의 종양 존재여부를 밝히는 데에 사용되며, 심장 기저부 종양이 어떤 유형의 종양인지 까지는 알아낼 수 없다. 심장초음파 검사 시 종괴, 심낭수, 심낭압전, 우심부전이 흔히 관찰된다. CT 또는 MRI는 종양의 정확한 위치, 전이 여부 및 특징을 밝히는 데에 사용되며, CT 상에서 대동맥소체종양은 인접한 근육과 비교했을 때 등감쇠에서 저감쇠를 보이며, MRI 상에서는 T1, T2 강조영상에서 고신호를 보인다. 또한 대동맥소체종양은 주로 좌심, 대동맥, 폐동맥과 인접하며, 조영 시 강하고 불균질한 조영 증강을 보인다. CT/MRI 상에서 나타나는 종양의 위치, 조영 증강 양상 등 영상학적 특징을 근거해 대동맥소체종양으로 추정 진단할 수 있다. 세포 검사 시 세포의 핵은 일반적으로 신경내분비 패턴의 풍부하며 노출된 핵의 모습을 가지며, 둥근 모서리와 핵소체가 있는 원형 내지 타원형 핵을 갖는 연한 파란색 세포질을 갖는다. 핵/세포질 비율은 중간 정도다.
일반적으로 심장 종양은 주변 혈관 또는 구조물에 침습하기 때문에 수술적 제거를 고려하지 않게 되는데, 이 환자의 경우 종양이 주변의 폐동맥이나 좌심방에 침습하지 않았으며, 원발 부위인 대동맥만 연관되어 있어 수술적 제거를 결정하게 되었다. 그리고 수술적 제거 외에도 심낭절제술을 같이 진행하였는데, 심낭 절제술은 대동맥소체종양 환자의 임상 증상 개선 및 생존 기간을 늘리는 데에 있어 좋은 치료 옵션 중 하나이기 때문이다. 한 연구결과에 따르면, 진단 시점에 심낭수 존재 여부와 상관없이 심낭절제술을 시행한 그룹의 중간 생존기간이 730일인 것에 비해, 심낭절제술을 시행하지 않은 그룹의 중간 생존기간은 42일이었다.(6) 심낭수가 있던 개의 생존기간이 늘어난 것은 당시 문제가 된 심낭수 축적을 해결하였기 때문이며, 심낭수가 없던 개의 생존기간이 늘어난 이유는 추후 종양에 의해 생길 수 있는 심낭수 축적을 예방했기 때문이다.
항암치료는 악성 대동맥소체종양을 치료함에 있어 고려할 수 있는 치료 방법이다. 본 증례에서는 가장 적합한 항암제를 선택하고자 항암제 감수성 검사(PDST)를 활용했다. PDST는 수술 또는 내시경을 통해 획득한 조직 생검 샘플을 가지고 3D 조직배양을 한 다음, 주치의가 선택한 10가지 항암제에 대한 효과를 검사하는 것이 특징이다. 이 검사의 장점으로는 첫번째, 3D 조직배양 기술로 최대한 생체 내에서와 가장 유사한 환경에서 배양한다는 것이다. 따라서 생체 내 실험 결과와 비교했을 때 높은 일치성을 갖게 된다. 두번째는 약제의 선택이 자유로워 단일 또는 복합약제 선택이 가능하며, 총 10가지의 약제를 선택할 수 있다는 것이다. 따라서 병원마다 사용가능한 약제, 논문을 통해 알게 된 효과적인 약제 등 여러 가지 약제에 대해 효과를 시험해 볼 수 있다. 세번째는 맞춤치료로 인해 치료비용이 절감되며, 치료효과 및 생존율을 높일 수 있다는 것이다. 또한 효과적이지 않은 약제의 사용을 피할 수 있게 돼 관련 약제에 의해 발생할 수 있는 부작용을 피할 수 있다. 네번째는 모든 고형암종에 대한 항암 효과 검사가 가능하다는 것이다.
PDST 검사를 위한 항암제 목록을 결정할 때 대동맥소체종양에 관한 여러 가지 항암 연구 결과들을 참고하려 했지만, toceranib에 관한 2가지 후향 연구(4, 12)와 1가지 증례보고(13) 뿐이었다. Toceranib은 추정 또는 확정 진단된 대동맥소체종양을 치료하기 위해 사용되어 왔다. Toceranib은 경쟁적으로 tyrosine kinase receptor를 억제시키는 TKI(tyrosine kinase inhibitor)이며, tyrosine kinase 억제 작용으로 인해 개의 많은 고형암에서 항혈관생성 및 직접적인 항종양 효과가 나타난다.(14, 15, 16) 대동맥소체종양에 toceranib을 적용한 2개의 후향 연구에 따르면, 다른 치료 옵션을 함께 적용시키지 않고 toceranib만 단독 투여해 치료했을 때의 중간 생존기간은 각각 478일, 823일로 밝혀졌다. Toceranib은 그동안 대동맥소체종양을 치료하기 위해 많이 사용되어 왔고 중간 생존기간이 478-823일 정도라면 괜찮은 예후라고 판단했기 때문에 항암제 목록에 toceranib을 포함시켰으며, 같은 TKI 계통인 imatinib도 포함시켰다. PDST 검사 결과 상 10가지 항암제 목록 중 carboplatin+imatinib 조합이 생체 외에서 항암효과가 가장 큰 것으로 나타났으며, 이 결과를 바탕으로 carboplatin+imatinib 조합의 항암치료를 진행했다.
본 증례에서 사용된 항암제 조합 중 하나인 Carboplatin은 2세대 백금 항암제다. 세포의 DNA 중 guanine에 결합하여 DNA 전사 및 복제를 억제하는 작용기전을 가지며, 세포 독성은 세포주기 어느 단계에서든지 발생가능하나 대부분 G1기나 S기에서 약물의 작용을 가장 받기 쉽다. Carboplatin은 정맥으로 투여하며, 주로 콩팥을 통해서 배설된다. Carboplatin의 부작용으로는 신독성, 이독성, 골수독성이 있으며, 개와 고양이 모두에서 사용가능하다. 만약 신장 기능이 정상이라면, 일반적으로 사전수화 필요없이 바로 투여가 가능하다.
본 증례에서 사용된 항암제 조합 중 다른 하나인 Imatinib은 PDGFRa/b 및 c-kit 같은 세포 표면 receptor kinase 뿐만 아니라 세포질 내 kinase인 ABL을 억제하는 TKI이며, 세포내 신호전달을 억제하는 역할을 한다. imatinib은 개와 고양이에서 지방세포종, 위장관기질종양, 주사부위육종을 치료하는 데에 사용되어 왔다. imatinib은 경구 투여 약물이며, 동물에 대한 imatinib 연구는 아직 많지 않아서 동물에 대한 부작용 정보는 적다. 사람의 imatinib에 대한 경증의 부작용에는 체액 정체/부종, 혈구 수 감소, 메스꺼움, 구토, 설사, 근육 경련, 근육 통증, 피부 발적, 기력 저하, 위 통증이 있다. 그리고 심각한 부작용에는 심부전, 간부전, 과도한 출혈, 고열, 위장관 궤양이 있다.
종양 진단 이후 지금까지 750일 정도 활력 및 식욕, 혈액 검사, 종양 크기 등을 꾸준히 추적관찰 해온 결과, 이 환자는 좋은 상태를 유지하고 있어 예후가 좋은 것으로 보인다. 하지만 toceranib 투여 연구 결과 중 중간 생존기간이 823일인 경우도 있으며, 823일에 도달하기 전에 갑작스러운 상태 변화가 발생할 수 있기 때문에 아직은 이 환자의 예후를 판단하기에는 이른 것으로 판단된다. 따라서 앞으로도 꾸준한 추적관찰이 필요할 것으로 보인다.
[Conclusion]
대동맥소체종양처럼 항암 치료 데이터가 적은 종양의 경우 본 증례와 같이 PDST를 활용한다면 항암 효과를 극대화하여 좋은 예후를 보일 것으로 기대된다. 반대로 항암 치료 데이터가 많은 종양이라고 하더라도 항암 효과는 개체별로 다를 수 있기 때문에 PDST를 이용한다면 환자 맞춤형 항암 치료를 진행할 수 있을 것이다.
[Reference]
1. Burton JH, Stern JA: Miscellaneous tumors: neoplasia of the heart. Small Animal Clinical Oncology, 6 ed. Elsevier 2020 pp. 787-91.
2. NICOLE EHRHART, VMD, E. J. EHRHART, DVM, PhD, JENNIFER WILLIS, DAVID SISSON, DVM, MS, PETER CONSTABLE, BVSc, PhD, CATHY GREENFIELD, DVM, MS, SANDRA MANFRA-MARETTA, DVM, and JOHN HINTERMEISTER, DVM. Analysis of Factors Affecting Survival in Dogs With Aortic Body Tumors
3. Withrow SJ, Vail DM, Page RL. Withrow & MacEwen’s Small Animal Clinical Oncology. 5th ed. St. Louis, Missouri: Elsevier (2013). p. 750.
4. Giovanna M. Coto1 , Margaret L. Musser 1 *, Melissa A. Tropf 1 , Jessica L. Ward1 , Yeon-Jung Seo2 , Jonathan P. Mochel 3 and Chad M. Johannes 1. A Multi-Institutional Retrospective Analysis of Toceranib Phosphate for Presumed or Confirmed Canine Aortic Body Chemodectomas
5. Treggiari E, Pedro B, Dukes-McEwan J, Gelzer AR, Blackwood L. A descriptive review of cardiac tumours in dogs and cats. Vet Comp Oncol. (2017) 15:273– 88. doi: 10.1111/vco.12167
6. Ehrhart N, Ehrhart EJ, Willis J, Sisson D, Constable P, Greenfield C, et al. Analysis of factors affecting survival in dogs with aortic body tumors. Vet Surg. (2002) 31:44–8. doi: 10.1053/jvet.2002.29989
7. Galac S, Korpershoek E. Pheochromocytomas and paragangliomas in humans and dogs. Vet Comp Oncol. (2017) 15:1158–70. doi: 10.1111/vco.12291
8. Orton EC: Surgery of the cardiavascular system, in Fossum TW (ed): Small Animal Surgery. St. Louis, MO, Mosby, 1997, pp 575-608
9. Ogilvie GK: Tumors of the endocrine system in Withrow SJ, MacEwen EG (eds): Small Animal Clinical Oncology. Philadelphia, PA, Saunders, 1996, pp 316-343
10. Hayes HM, Sass B: Chemoreceptor neoplasia: A study of the epidemiological features of 357 canine cases. Zentralbl Veterinarmed [A] 35:401-408, 1988
11. Pedro B, Linney C, Navarro-Cubas X, Stephenson H, Dukes-McEwan J, Gelzer AR, et al. Cytological diagnosis of cardiac masses with ultrasound guided fine needle aspirates. J Vet Cardiol. (2016) 18:47–56. doi: 10.1016/j.jvc.2015.0 9.002
12. Lew FH, McQuown B, Borrego J, Cunningham S, Burgess KE. Retrospective evaluation of canine heart base tumors treated with toceranib phosphate (Palladia R ): 2011–2018. Vet Comp Oncol. (2019) 17:465–71. doi: 10.1111/vco.12491
13. Lew FH, McQuown B, Borrego J, Cunningham S, Burgess KE. Retrospective evaluation of canine heart base tumors treated with toceranib phosphate (Palladia⃝R ): 2011–2018. Vet Comp Oncol. (2019) 17:465–71. doi: 10.1111/vco.12491
14. London C, Mathie T, Stingle N, Clifford C, Haney S, Klein MK, et al. Preliminary evidence for biologic activity of toceranib phosphate (Palladia⃝R ) in solid tumours. Vet Comp Oncol. (2012) 10:194–205. doi: 10.1111/j.1476-5829.2011.00275.x
15. London CA, Hannah AL, Zadovoskaya R, Chien MB, Kollias-Baker C, Rosenberg M, et al. Phase I dose-escalating study of SU11654, a small molecule receptor tyrosine kinase inhibitor, in dogs with spontaneous malignancies. Clin Cancer Res. (2003) 9:2755–68.
16. Zoetis. Palladia (package insert). Kalamazoo, MI: Zoetis Inc. (2015).