-
학회 [강의]
 조윤주 연구소장님 광진구와 건국대가 함께하는 반·반학교 강의 소식
조윤주 연구소장님 광진구와 건국대가 함께하는 반·반학교 강의 소식안녕하세요. VIP동물의료센터입니다. :)'광진구와 건국대가 함께하는 반·반학교'에서 강의 하시게 된 VIP동물의료센터 부설연구소 조윤주 연구소장님의 소식을 전합니다. :)10월 21일 토요일에 강의 예정13:30~14:30 반려동물과 건강하게 함께 살기 114:30~15:30 반려동물과 건강하게 함께 살기 2반려동물과 보호자를 위해 다양한 강의에 강사로 참여하고 있는VIP동물의료센터 선생님들의 소식, 앞으로도 꾸준히 전해드리겠습니다. :) 자세한 것은 포스터를 참고해주세요! :)
23.08.29 -
학회 [강의]손지희 원장님·조윤주 연구소장님 농식품부 '반려동물 입양자 교육' 강의 소식
안녕하세요. VIP동물의료센터입니다. :)농림축산식품부와 농림수산식품교육문화정보원에서9/3일 실시하는 '반려동물 입양자 교육'에서 강의하시게 된- 손지희 VIP동물의료센터 청담점 원장님- 조윤주 VIP동물의료센터 연구소장님두분의 소식을 전합니다. :)2023년 동물보호복지 대국민교육 반려묘 보호자교육 (9월 3일)동물사랑배움터 일반회원 가입 -> 오프라인 수강신청,또는 카카오톡 플러스 친구 [동물사랑배움터신청] 채널추가 후 접수(30명 내외, 동물등록, 필수예방접종 완료된 반려견 동반 가능) 관심있으신 분들의 많은 신청 바랍니다. :)
23.08.28 -
학회 [강의]
 신사경 원장님, '2023 부산수의콘퍼런스'에서 수의사 대상 재활 강의 진행
신사경 원장님, '2023 부산수의콘퍼런스'에서 수의사 대상 재활 강의 진행신사경 원장님, '2023 부산수의콘퍼런스'에서 수의사 대상 강의 진행지난 20일 부산 벡스코에서 열린 '2023 부산수의컨퍼런스'에서'VIP동물한방재활의학센터byDr신사경'에 신사경 원장님께서재활 강의를 진행하셨습니다.부산수의컨퍼런스는 부산시 수의사회와 한국고양이수의사회,한국수의심장협회가 주최한 반려동물 임상 학술행사로 매년 많은 수의사와 수의대생, 동물보건사, 수의료업체가 참여하고 있습니다.올해는 2000여명의 수의사, 수의대생이 모였고△내과 △외과 △심장학 △영상의학과 △재활 관련한 분야의 강의도 듣고다양한 동반 성장 원동력에 관한 기반을 습득할 수 있는정보도 공유받을 수 있어 더 뜻 깊은 자리가 되었습니다. VIP동물의료센터, 동물한방재활의학센터 수의사들은다양한 학회와 컨퍼런스에 강사로 참여 하며 실제 치료에 실용적으로 쓰이고증상을 개선시키는데 효과적인 방법들을 공유하고 교육하고 있습니다. 앞으로도 꾸준히 활동하여 수의학 발전에 기여하겠습니다. :)
23.08.23 -
논문 [학술지]
 [VIP동물의료센터 학술활동] 전십자인대질환과 함께 Pivot-shift phenomenon이 나타난 환자에서 TPLO와 extracapsular suture를 사용한 수술 증례 23.07.12
[VIP동물의료센터 학술활동] 전십자인대질환과 함께 Pivot-shift phenomenon이 나타난 환자에서 TPLO와 extracapsular suture를 사용한 수술 증례 23.07.12 -
논문 [학술지]
 [VIP동물의료센터 학술활동] 고양이 티아민 결핍증(thiamine deficiency)의 치료 증례 23.07.11
[VIP동물의료센터 학술활동] 고양이 티아민 결핍증(thiamine deficiency)의 치료 증례 23.07.11 -
논문 [포스터]
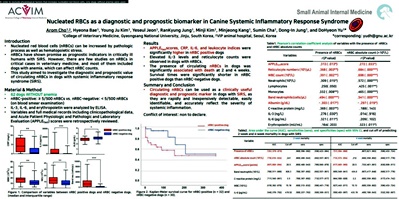 [2023 미국수의내과학회 (ACVIM)] Nucleated RBC count as a diagnostic and prognostic indicator in canine sy...
[2023 미국수의내과학회 (ACVIM)] Nucleated RBC count as a diagnostic and prognostic indicator in canine sy...VIP동물의료센터 청담점 조아롬 수의사 팀장, [2023 미국수의내과학회(ACVIM)] 포스터 발표[ 자세한 내용은 첨부파일로 확인하실 수 있습니다. ]
23.07.07
Academic achievement
VIP동물의료센터 의료진들은
전문적인 학술활동으로 임상교류를 넓혀갑니다.