약물 및 외과적 처치를 통한 고양이 재발성 농흉 치료 증례
- 작성자
- 관리자
- 등록일
- 2024-03-12
- 조회수
- 3,963
약물 및
외과적 처치를 통한
고양이
재발성 농흉 치료 증례
VIP동물의료센터
이예빈 수의사
박종원 수의사
김선영 외과 부장
김종인 원장
장효미 수의사
서론
농흉은 흉강 내 감염성 삼출물의 축적이 특징적인 질환으로 이물이나 흉벽의 관통상, 식도의 열상, 폐 감염의 확장 때문에 발생할 수 있다. 하지만 대부분의 경우 특발성이며, 이는 특히 고양이에서 그렇다.(1) 농흉은 주로 어린 성묘에서 발생하나(평균 3-6세) 어느 연령대에서든 나타날 수 있다. 현재까지의 보고에 따르면 통계적으로 유의미한 성별 및 품종 소인은 확인되지 않았다.(2,3)
농흉이 발생한 개체에서는 빈 호흡이나 호흡곤란, 청진 시 폐음의 감소가 관찰되며, 복강의 호흡운동 증가가 나타날 수 있다. 열이나 무기력감, 식욕감소와 체중감소 등도 흔하게 나타나며 패혈성 쇼크를 보이거나 전신 염증반응 증후군(systemic inflammatory response syndrome)을 나타낼 수도 있다.(1) 혈액검사 상에서는 빈혈이나 저알부민혈증, 고글로불린혈증, 전해질 불균형, 미약한 간효소 수치 상승 등이 확인될 수 있다.(2)
농흉을 초기에 진단하고 집중적인 치료가 진행된 경우 예후는 좋은 편이다.(1) 2021년 발표된 47마리의 농흉 고양이를 대상으로 진행된 연구에서, 치료가 적절하게 진행되었을 경우 단기생존율(2주)과 장기생존율(1년)이 모두 72%와 68%로 높았으며 재발률은 2%에 불과하였다.(5)
본 증례에서는 농흉이 재발한 고양이에서 흉관 장착, 장기간의 흉강 배액 및 세척, 항생제 처치를 통한 치료 성공 증례를 소개하고자 한다.
증례
10살 중성화 수컷 아메리칸 컬 고양이가 호흡곤란과 기력저하, 체중감소를 주증으로 본원으로 내원하였다. 전신 컨디션은 저하되어 있었으며, 신체검사상 수축기 혈압이 74mmHg로 측정되었다.
혈액 검사상 빈혈(hematocrit, HCT 22%)과 백혈구증가증(WBC 51.98 K/μL), BUN 상승 (43 mg/dL)이 확인되었으며 (참고: creatinine 0.8 mg/dL), 고단백혈증 및 고글로불린혈증 (total protein: 7.7 g/dL, globulin: 5.3 g/dL, albumin/globulin ratio: 0.4), serum amyloid A (SAA) 상승(24.9 mg/mL)이 확인되었다. 흉부 방사선 검사상에서는 중등도 이상의 흉수 소견이 확인되었다. [그림1]
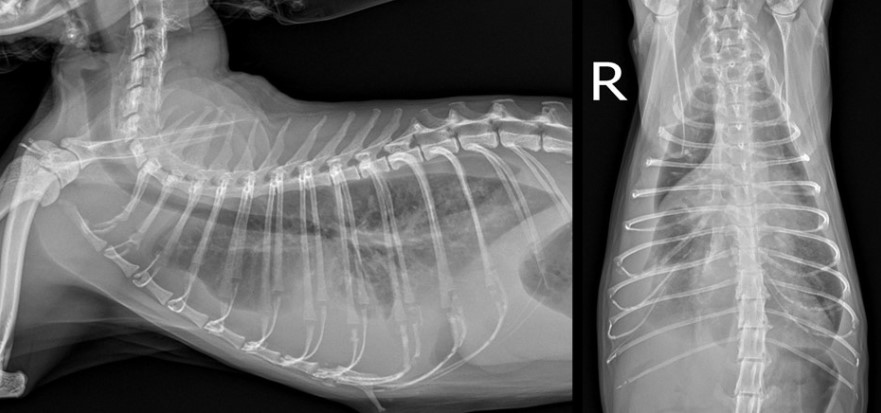
[그림1] 첫 내원 당시 흉부방사선 사진
흉수로 인한 호흡곤란 완화와 흉수 검사를 위해 천자를 실시했으며, 육안상 노랗고 불투명하며 끈적한 흉수를 100mL 제거하였다. [그림2] 세포 검사상 퇴행성 호중구가 주로 관찰되고 대식구와 림프구가 소수 확인되었으며 세포질 및 세포 외부에서 간균과 구균, 단간균이 현저히 관찰되었다. [그림3]

[그림2] 채취한 흉수

[그림3] 흉수의 세포 검사 사진
채취한 흉수를 통해 미생물 배양 및 항생제 감수성 검사를 의뢰하였고, 그람음성 혐기성 간균인 Fusobacterium russii 이 동정되었다. 흉수를 유발할 수 있는 고양이 전염성 복막염 (Feline Infectious Peritonitis, FIP)을 배제하기 위한 PCR 검사에서 음성으로 확인되어 FIP는 배제되었다.
환자는 항생제 감수성 결과가 나오기 전까지 입원 및 경험적 항생제 투여를 통해 치료를 진행했다. 혐기성 균에 잘 작용하는 amoxicillin-clavulanate (AMC) (12.5 mg/kg IV q12h), metronidazole (10 mg/kg IV q12h)과 그람 음성균에 잘 작용하는 fluoroquinolone 계열의 marbofloxacin (2.75 mg/kg IV q24h)을 병용하였다. 입원 치료 8일 후 농흉과 SAA, 전반적인 CBC 수치가 개선되어 퇴원하였고, 이는 퇴원 시 방사선 사진이다. [그림4]
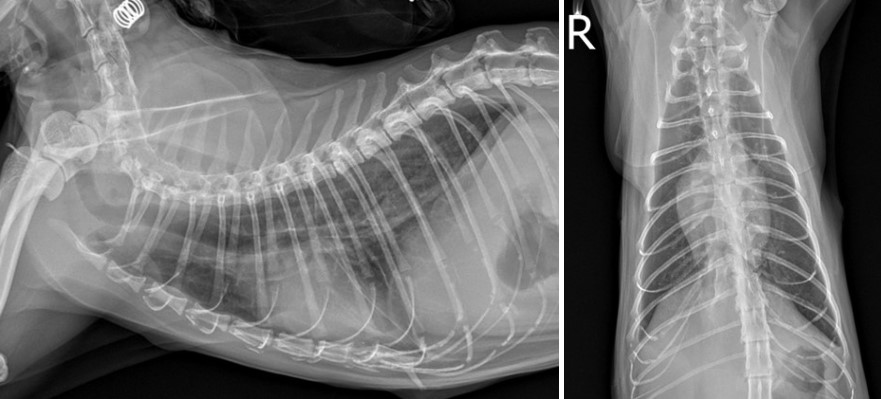
[그림4] 8일간의 입원치료 후 퇴원 시 방사선 사진
항생제 감수성 검사 결과에 따라 경구용 항생제(AMC 12.5mg/kg q12h, marbofloxacin 2mg/kg q24h)를 처방하였고 2주 뒤 농성 흉수가 사라지고 항생제 부작용으로 의심되는 위장관 증상이 나타나 항생제 투약을 중단하였다.
환자는 퇴원 후 2달 뒤 농흉 재발로 인한 호흡곤란 및 기력저하로 다시 내원하였다.
혈액 검사상 빈혈(HCT 22.9%)과 백혈구증가증 (WBC 29.44 K/μL), SAA 상승(17.3 mg/mL)이 확인되었다. 흉부방사선 상 우측 후폐엽의 음영 증가와 함께 뒤쪽 종격동의 연부조직 음영이 확인되어 computed tomography (CT) 검사를 진행하였다.[그림5] CT 검사를 토대로, 방사선상 확인되었던 연부조직 음영의 구조물은 caudal mediastinal paraesophageal empyema로 가진단 되어 입원하여 항생제 반응성과 염증 수치 및 전반적인 활력 등을 모니터링하였다.
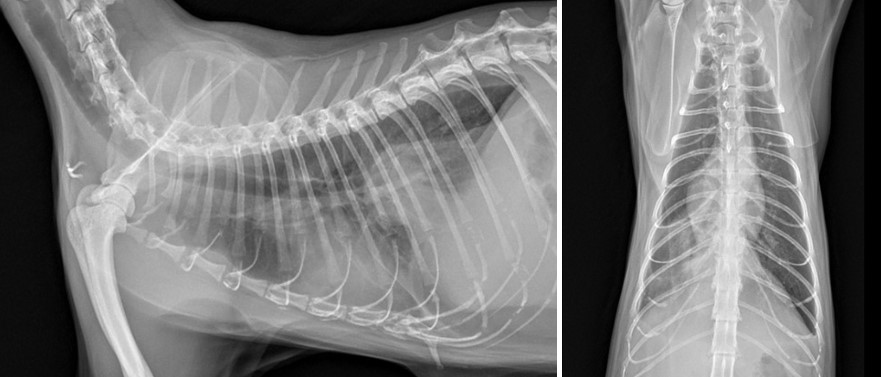
[그림5] 농흉 재발 시 흉부 방사선 사진
일차적으로 첫 발증시와 동일한 항생제를 동일 용량으로 사용하였다. (Amoxicillin-clavulanate (12.5mg/kg IV q12h), metronidazole (10mg/kg IV q12h), marbofloxacin (2.75mg/kg IV q24h)) 첫 발증 시에는 항생제 처치에 빠르게 반응하여 흉수 양과 염증수치의 뚜렷한 개선이 있었으나, 재발 후에는 동일한 항생제 처치에도 불구하고 흉부 방사선 상 흉수가 점점 증가 하였고 혈액 검사상에서도 큰 호전을 보이지 않았다. 따라서 metronidazole을 중단하고, meropenem (10 mg/kg IV q8h) 처치를 추가하였다. 그럼에도 치료 반응을 보이지 않고 식욕 및 활력의 악화 소견을 보여 재발 12일 경과 후 외과적 처치를 실시하였다.
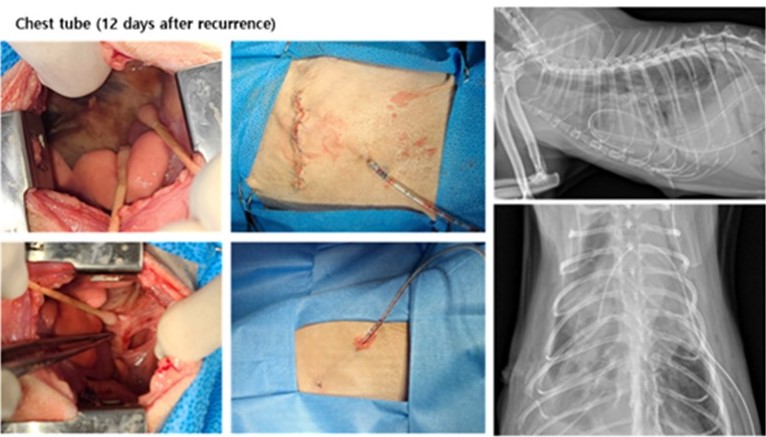
[그림6] 탐색적 개흉술, 흉관 장착 / 술후 흉부 방사선
개흉을 통한 육안 평가 시, 우측 흉강 전반에서 섬유소성 흉막염과 횡격막의 비후 및 염증성 변화가 확인되었다. 우측 폐 대부분이 어둡게 변색되어 조직의 병리적 변화가 진행되어 있었고 일부만 정상 폐조직으로 확인되었다. 우측 폐중엽과 후엽이 서로 유착되어 횡격막에 부착되어 있어 수술적으로 염증 조직을 제거하고 유착되어 있는 부분을 분리하였다. 이후 흉관을 장착하여 장기적으로 양측 흉강에서 공기와 삼출물 제거를 계획하였다.
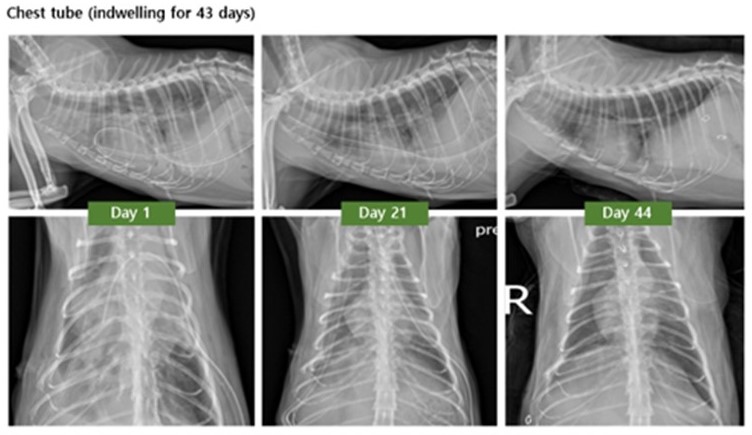
[그림7] 치료 기간 동안 흉부 방사선 변화 양상
흉관 장착 후 흉강 세척은 양측 흉관에서 최대한의 흉수를 제거한 후 따뜻한 heparinized H/S 20 mL, H/S 20 mL씩을 주입 후 제거하는 방식으로 매일 두 번씩 진행했다. 이와 함께 장기간의 항생제 치료를 병행하였다. 방사선 검사 결과에서는 소량의 흉수가 지속되었으나 흉수 검사에서는 더이상 감염체가 확인되지 않았다. 하지만 염증세포와 염증성 삼출물이 지속적으로 확인되어 잔존한 염증에 의해 흉수가 지속적으로 유발되고 있을 것으로 추측되어 소염제를 추가 처방하고 흉수가 감소되는지 모니터링하였다.
환자는 퇴원 후 prednisolone, PDS 0.5 mg/kg PO q12h, omeprazole 0.5 mg/kg PO q12h, pentoxifylline 10 mg/kg PO q12h, meropenem 8.5 mg/kg SC q12h 처치를 진행하며 상태를 모니터링하였다. 이후 흉수의 양이 현저히 줄어들고 세포학적 검사 결과 변성 호중구와 세균이 더이상 확인되지 않아 흉관 장착 43일째에 양측 흉관을 모두 제거하였다.
이후 60일동안 내복약을 서서히 감량하며 다음과 같이 약물 처방을 실시하였다.
(최종 용법 : PDS 0.2 mg/kg PO EOD, omeprazole 0.5 mg/kg PO EOD, pentoxifylline 10 mg/kg PO EOD).

[그림8] 치료 기간 동안 주요 이벤트를 나타낸 타임라인
고찰
고양이 농흉의 치료에서는 약물과 외과적 처치를 모두 선택할 수 있지만, 최적의 치료법이 어떤 것인지에 대한 의견은 현재까지도 다양하며 이들의 효능을 평가하고 비교하는 연구가 부족하고 농흉 환자의 증례수도 많지 않아 의미 있는 결론 도출이 어려운 실정이다. 하지만, 많은 문헌에서 농흉 관리 시 가장 먼저 고려해야할 것은 약물 치료라는 의견이 대부분이다. 최근 농흉 고양이를 대상으로 한 연구에서 85%(n=47마리)가 약물 치료를 통해 농흉이 개선되었고, 단 5마리의 고양이만이 약물 치료에 반응하지 않아 수술적 처치가 고려되었다.(2,3,5,6)
흉강천자를 통해 채취한 흉수의 미생물 배양과 항생제 감수성 결과가 나오기 전까지 일반적으로 광범위 항생제가 선택되며, Actinomyces spp.에 대해서도 효능이 있는 amoxicillin-clavulanic acid가 우선적으로 고려될 수 있다. 그리고 그람 음성균에 효과적인 fluoroquinolone 계열의 항생제 역시 선택될 수 있다. 이후 항생제 감수성 검사 결과에 따라 감수성 있는 항생제로 변경되어야 하며 임상 증상이 나타나지 않을 때까지 최소 3-4주 동안 치료가 필요하다.(2,6,7)
2~7일 후에도 약물 치료에 대한 반응이 부적절할 경우, 즉 임상적으로 호전을 보이지 않고 지속적인 발열이나 흉수 증가 양상이 확인되는 경우 외과적 처치를 고려해야 한다.(2,3,5,6) 이러한 개체에서는 탐색적 개흉술이 지시되며 섬유화된 조직이나 염증에 이환된 조직을 제거하기 위한 수술이 필요할 수 있다.(1)
개를 대상으로 한 연구에서 흉관을 통해 배액만 단독으로 실시했을 때보다 배액과 세척을 함께 했을 때의 이점이 보고되었다. 흉강 내 어떤 액체도 없도록 최대한 흉수를 제거한 후 흉강 내로 따뜻한 멸균 생리식염수를 약 10 mL/kg로 천천히 주입한다. 처치 중 환자에게 스트레스가 가해질 경우 언제라도 시도를 중단해야 한다. 동물을 조심스럽게 양쪽으로 굴린 후 주입된 액체를 다시 제거하며 이러한 과정들은 철저하게 무균적으로 행해져야 한다. 주입한 양의 75% 이상은 제거되어야 하는데 이것보다 더 적은 양만 회수된다면 더 이상 흉관을 통해 적절한 배액이 되고 있지 않음을 의미하며, 흉수 및 흉관의 상태를 방사선이나 초음파로 평가해야 한다. 세척액에 항생제나 항균제, 효소를 첨가하는 것이 더 이점을 가진다는 것은 알려지지 않았다. 하지만 헤파린(1000-1500 U/100 mL)을 세척액에 첨가하는 것은 섬유소 형성을 감소시켜, 더 좋은 결과를 보였다.(1,8)
배액을 멈추고 흉관을 제거할 것인지에 대한 결정은 배액된 흉수의 양과 세포학적 검사를 바탕으로 해야한다. 배액양이 2 mL/kg/day 이하로 감소되는 경우 배액관 제거를 고려할 수 있다. 세포학적 평가 시 세포 내/외에서 세균이 더 이상 관찰되지 않아야 하며, 호중구는 지속적으로 나올 수 있지만 변성되지 않아야 한다. 이러한 요건을 모두 만족시키거나 흉부 방사선 상에서 더 이상 흉수가 발견되지 않을 시 흉관을 제거할 수 있으며, 흉관 제거 후 최소 24시간까지는 기흉이나 흉수의 재발에 대한 모니터링이 필요하다.(1)
[결론]
본 증례는 농흉의 재발과 이에 따른 약물 및 외과적 처치를 실시한 고양이 환자를 소개한 것으로, 농흉이 처음 발생했을 때는 약물에 대한 반응이 좋아 단기간의 항생제 처치로 임상증상이 현저히 완화되었다. 하지만 2달 후 재발한 농흉에서는 약물 치료에 대한 반응성이 떨어져 탐색적 개흉술 및 흉관 장착을 통한 외과적 개입을 병행하였다. 이후 흉관을 약 40일간 유지하며 흉강 배약과 세척, 항생제 처치를 실시하였고, 이를 통해 좋은 예후를 보였다. 탐색적 개흉술과 흉관을 통한 배액 및 세척을 병행하는 치료방법은 내과적 처치로 개선되지 않는 고양이 농흉에서 추천할만한 치료법으로 고려될 수 있다.
References
(1) Nelson, Richard W., and C. Guillermo Couto. Small Animal Internal Medicine: Small Animal Internal Medicine. Elsevier Health Sciences, 2019.
(2) Stillion JR, Letendre J. A clinical review of the pathophysiology, diagnosis, and treatment of pyothorax in dogs and cats. J. Vet. Emerg. Crit. Care (San Antonio) 2015;25(1):113-129.
(3) Waddell LS, Brady CA, Drobatz KJ. Risk factors, prognostic indicators, and outcome of pyothorax in cats: 80 cases (1986-1999). J. Am. Vet. Med. Assoc. 2002;221(6):819-824.
(4) Ettinger, Feldman, Cote. Textbook of Veterinary Internal Medicine.8th ed
(5) Krämer F, Rainer J, Bali MS. Short‐ and long‐term outcome in cats diagnosed with pyothorax: 47 cases (2009‐2018). J. Small Anim. Pract. 2021;62(8):669-676.
(6) Epstein SE, Balsa IM. Canine and feline exudative pleural diseases. Vet. Clin. North Am. Small Anim. Pract. 2020;50(2):467-487.
(7) Lappin MR, Blondeau J, Boothe D, et al. Antimicrobial Use Guidelines for Treatment of Respiratory Tract Disease in Dogs and Cats: Antimicrobial Guidelines Working Group of the International Society for Companion Animal Infectious Diseases. J. Vet. Int. Med. 2017;31(2):279-294.
(8) Boothe HW, Howe LM, Boothe DM, et al. Evaluation of outcomes in dogs treated for pyothorax: 46 cases (1983-2001). J. Am. Vet. Med. Assoc. 2010;236(6):657-663.